近日,德国癌症研究中心研究人员 Rothenberg 在 Nature 发表的最新研究揭示:挑食或许不仅仅是个人口味的问题,而是免疫系统在保护你的身体!
下面让我们一起来看看,身体为了不吃讨厌的食物,是怎么运筹帷幄、调兵遣将的吧~

挑食的一种行为是回避和厌恶与过敏有关的食物。回避反应涉及到一种需要抗体反应的神经免疫途径 (依赖于一种称为 IgE 的抗体)。该途径依赖被称为肥大细胞的肠道免疫细胞的激活。这些细胞会产生和释放促进炎症有关的因子白三烯(图 1)。
产生回避反应的三要素:IgE 抗体依赖性的神经免疫;肥大细胞的肠道免疫细胞的激活;白三烯分子的产生和释放。
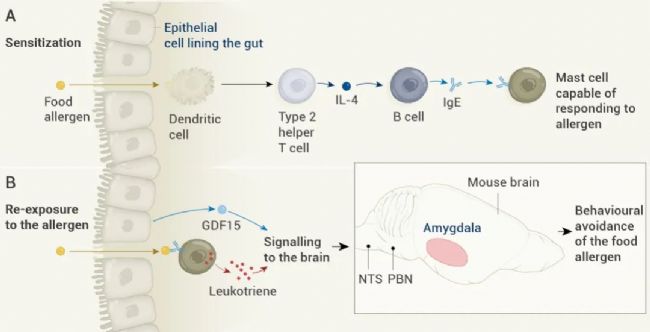 图 1. 与食物过敏相关的食物厌恶行为中涉及的免疫反应[1]。
图 1. 与食物过敏相关的食物厌恶行为中涉及的免疫反应[1]。
注:肥大细胞 (Mast cell) 是存在于暴露于内部和外部环境的屏障组织中的造血细胞。在免疫球蛋白 E (IgE) 介导的过敏中发挥作用。 图解:
图解:
A、致敏作用 (Sensitization):如果肠道中的食物穿过上皮细胞进入肠道组织,就会引发过敏反应。对过敏原的致敏需要各种免疫细胞和信号分子。树突状细胞 (Dendritic cells)捕获过敏原并激活 2 型辅助性 T 细胞 (Type 2 helper T cells),后者释放细胞因子蛋白 IL-4。这会触发免疫细胞 B 细胞 (B cells) 释放一种叫做 IgE 的抗体,这种抗体能够识别特定的过敏原。这种 IgE 与肥大细胞 (Mast cell) 结合。
B、再次接触过敏原 (Re-exposure to the allergen):如果动物随后遇到这种过敏原,肥大细胞 (Mast cell) 会释放一种叫做白三烯 (Leukotrienes) 的分子,上皮细胞会释放一种叫做 GDF15 的蛋白质。这些因素最终导致被称为孤束核(Nucleus of tractus solitaries,NTS)、臂旁外侧核 (Parabrachial nucleus,PBN) 和杏仁核 (Amygdala) 的大脑区域的激活,这些区域处理信号输入以驱动行为反应。这一系列事件可能解释了老鼠如何避免食用含有过敏原的食物。
同期上线的两篇 Nature 文章为动物的食物回避行为提供了实验性证据。让我们一起来看看吧~

过敏会诱发小鼠对过敏原食物的回避行为
两组研究人员在免疫系统刺激剂 (Aluminium hydroxide, alum, 称为佐剂) 存在的情况下,通过注射食物过敏原——鸡蛋蛋白卵清蛋白 (Ovalbumin, OVA),诱导小鼠产生食物过敏。然后,他们将这些动物重新暴露于过敏原中。作者发现,当让小鼠在单独饮用水和含有过敏原的水之间做出选择时,免疫致敏会导致小鼠避开过敏原[2][3]。
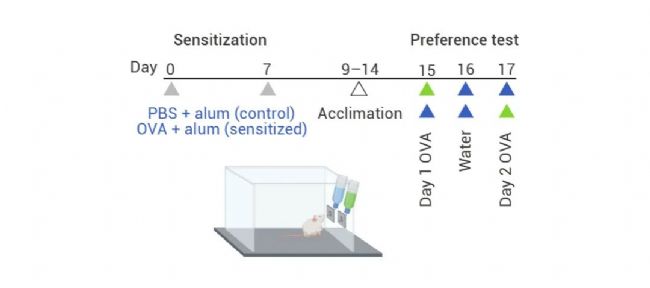
图 2. 过敏致敏和行为测定的示意图[3]。
过敏诱发的回避行为依赖于肥大细胞和 IgE
Plum 等人的实验发现经过基因工程改造具有肥大细胞缺陷的 CPA3CRE/+ 致敏小鼠则不产生回避反应。
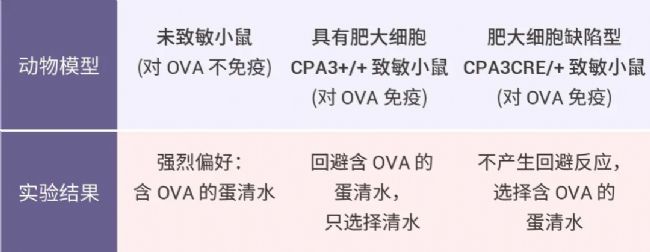
注:对 OVA 免疫致敏,即前期通过注射食物过敏原 OVA,诱导小鼠产生食物过敏。然后,他们通过肠道将这些动物重新暴露于过敏原中。对 OVA 免疫的小鼠会避开食物过敏原 OVA。
此外,肥大细胞可以通过高亲和力 IgE 受体 (FcεRI) 被抗原和 IgE 激活。研究团队进一步测试了 IgE 在抗原回避行为中的作用。结果显示 IgE 和肥大细胞都是抗原回避行为的必要条件。

然而,这些抗体是有害的,并且在接触食物过敏原后会引起过敏症状。在早期阶段,IgE 会促进过敏防御,例如回避行为,但长期接触过敏原后,IgE 会导致疾病。
肥大细胞或通过免疫-大脑轴调节回避行为
然而,肥大细胞对于回避行为的调节并非依赖于单一因素,而是一个复杂的过程。
动物通过胃和小肠的肥大细胞快速感知抗原,抗原回避行为不仅依赖于肥大细胞和IgE。辅助 T 细胞是最初暴露于过敏原诱导的免疫系统适应性分支的细胞,2 型辅助 T 细胞分泌的细胞因子 (如 IL-4) 也促进回避。
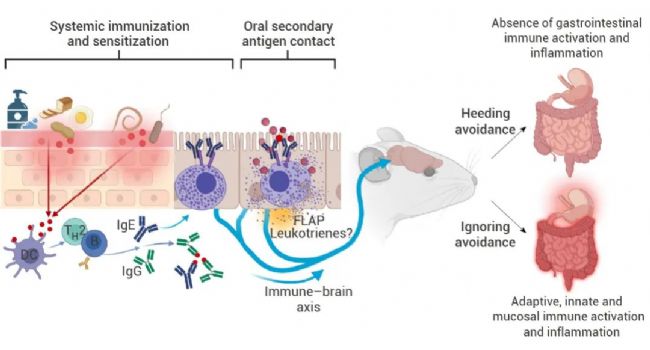 图 3. 肥大细胞和 IgE 促进免疫回避[2]。
图 3. 肥大细胞和 IgE 促进免疫回避[2]。
屏障损伤促进抗原入侵 (例如生活中常见的面粉、鸡蛋或花生以及病原体的蛋白质),导致 2 型免疫反应。适应性免疫则产生特异性 IgG 和 IgE 抗体,用于抗原中和。抗原特异性 IgE 进一步与肥大细胞结合,等肥大细胞再次遇到抗原时,就能发出回避行为的信号。而 FLAP 依赖性白三烯的抑制会损害回避,可能在免疫-脑神经这条轴上发生作用。如此,具有回避表现的小鼠在很大程度上保护了自己,不会发生胃肠道免疫激活和炎症。如果丧失回避能力,或者回避被忽视时就会导致机体炎症。
过敏原暴露诱导肠道上皮细胞产生剂量依赖性的生长和分化因子 15 (Growth and differentiation factor 15,GDF15)。GDF15 的产生依赖于 IL-4、IgE 和白三烯的阻断。GDF15 可以与孤束核和脑后区域的受体结合,对有害刺激产生恶心反应,这一过程与处理与学习有关的感觉神经元信号有关。同时,研究人员提出可能存在一个“免疫-大脑轴”共同完成调节。但其潜在机制尚不清楚,大脑如何引发回避反应也是一个悬而未决的问题。
此外,研究人员推测,即使在没有明显过敏迹象的个体中,潜在的免疫介导机制也可能有助于食物选择。
 一方面,过敏原特异性回避行为可能有助于避免暴露于环境危险中。然而,当它干扰口服免疫疗法(一种通过重新引入越来越多的引发过敏的食物来治疗食物过敏的方法)时,食物厌恶可能是弊大于利的。现有的药物可以精确地靶向已确定的过敏介质。
一方面,过敏原特异性回避行为可能有助于避免暴露于环境危险中。然而,当它干扰口服免疫疗法(一种通过重新引入越来越多的引发过敏的食物来治疗食物过敏的方法)时,食物厌恶可能是弊大于利的。现有的药物可以精确地靶向已确定的过敏介质。
例如,Omalizumab 是一种阻断 IgE 的抗体,被批准用于治疗哮喘等疾病,在早期临床研究的基础上,显示出治疗食物过敏的希望。Dupilumab 是临床批准的阻断 IL-4 信号传导的抗体。
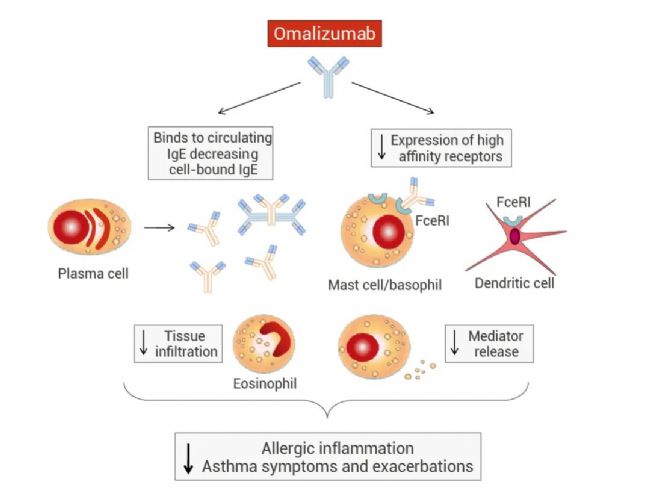 图 4. Omalizumab 的作用机制[6]。
图 4. Omalizumab 的作用机制[6]。
Omalizumab 与 IgE 结合,从而形成免疫复合物,降低循环游离 IgE 水平,并阻止它们与树突状细胞、肥大细胞、嗜碱性细胞和嗜酸性细胞表达的高亲和力 IgE 受体 (FcɛRI)相互作用。因此,IgE 依赖性抗原呈递、肥大细胞/嗜碱性粒细胞脱颗粒(Mast cell/basophil degranulation)和嗜酸性粒细胞浸润(Eosinophil infiltration)受到抑制。用 Omalizumab 进行抗 IgE 治疗也会导致 FcɛRI 表达降低。所有这些作用都能减少过敏性气道炎症,以及相关的哮喘症状和恶化。
Plum 等人和 Florsheim 等人鉴定的白细胞-三烯类型很容易被临床可用的药物阻断,这些药物会干扰分子的合成或受体介导的信号传导。此外,一种消耗肥大细胞的抗体正处于早期临床开发中。除了抗过敏治疗策略,基于 GDF15 的药物正在临床前动物模型中进行测试。 经过上面的介绍,我们一起了解了身体产生挑食意愿的科学机制。当我们摄入可能引起过机体过敏的抗原,就会激活厌恶性刺激反应的神经元,催促大脑快快拒绝,连忙 “退,退,退!”。然而大脑如何引发回避反应一直是一个悬而未决的问题,等待各位科研汪的探寻!
经过上面的介绍,我们一起了解了身体产生挑食意愿的科学机制。当我们摄入可能引起过机体过敏的抗原,就会激活厌恶性刺激反应的神经元,催促大脑快快拒绝,连忙 “退,退,退!”。然而大脑如何引发回避反应一直是一个悬而未决的问题,等待各位科研汪的探寻!
| OVA 可用于诱导免疫的卵清蛋白。 |
| Aluminum Hydroxide 具有口服活性的铝佐剂,固有免疫原性低。 |
| c-Fos Antibody FOS 抗体,可用于检测 FOS 水平。 |
| LTB4 白细胞诱导剂及激活剂。 |
| Montelukast CysLTR1 的拮抗剂,CysLTR1 是半胱氨酰白三烯的下游受体,可传递动物产生食物回避行为的信号。 |
| HAMI3379 CysLTR2 的拮抗剂,CysLTR2 是半胱氨酰白三烯的下游受体,可传递动物产生食物回避行为的信号。 |
MCE的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
参考文献:
[1] Rothenberg ME. The immunology that underlies picky eating. Nature. 2023 Aug;620(7974):497-499.
[2] Plum T, et al. Mast cells link immune sensing to antigen-avoidance behaviour. Nature. 2023 Aug;620(7974):634-642.
[3] Florsheim EB, et al. Immune sensing of food allergens promotes avoidance behaviour. Nature. 2023 Aug;620(7974):643-650.
[4] Butler RK, et al. Activation of phenotypically-distinct neuronal subpopulations of the rat amygdala following exposure to predator odor. Neuroscience. 2011 Feb 23;175:133-44.
[5] Campos CA, et al. Encoding of danger by parabrachial CGRP neurons. Nature. 2018 Mar 29;555(7698):617-622.
[6] Pelaia G, et al. Update on optimal use of omalizumab in management of asthma. J Asthma Allergy. 2011;4:49-59 .
