重组腺相关病毒(rAAV)作为一种靶向性高和安全性好的病毒载体,被广泛用于基因的传递和表达,也被认定为未来非常有前景的基因治疗载体。早在上世纪90年代科学家就选择肺作为靶向实验器官,利用rAAV进行肺部疾病的临床研究。众所周知,rAAV的转导效率与AAV血清型及给药途径等因素息息相关,今天小V就带大家一起学习一下在肺部应用中有关AAV血清型、启动子及给药途径的选择策略。
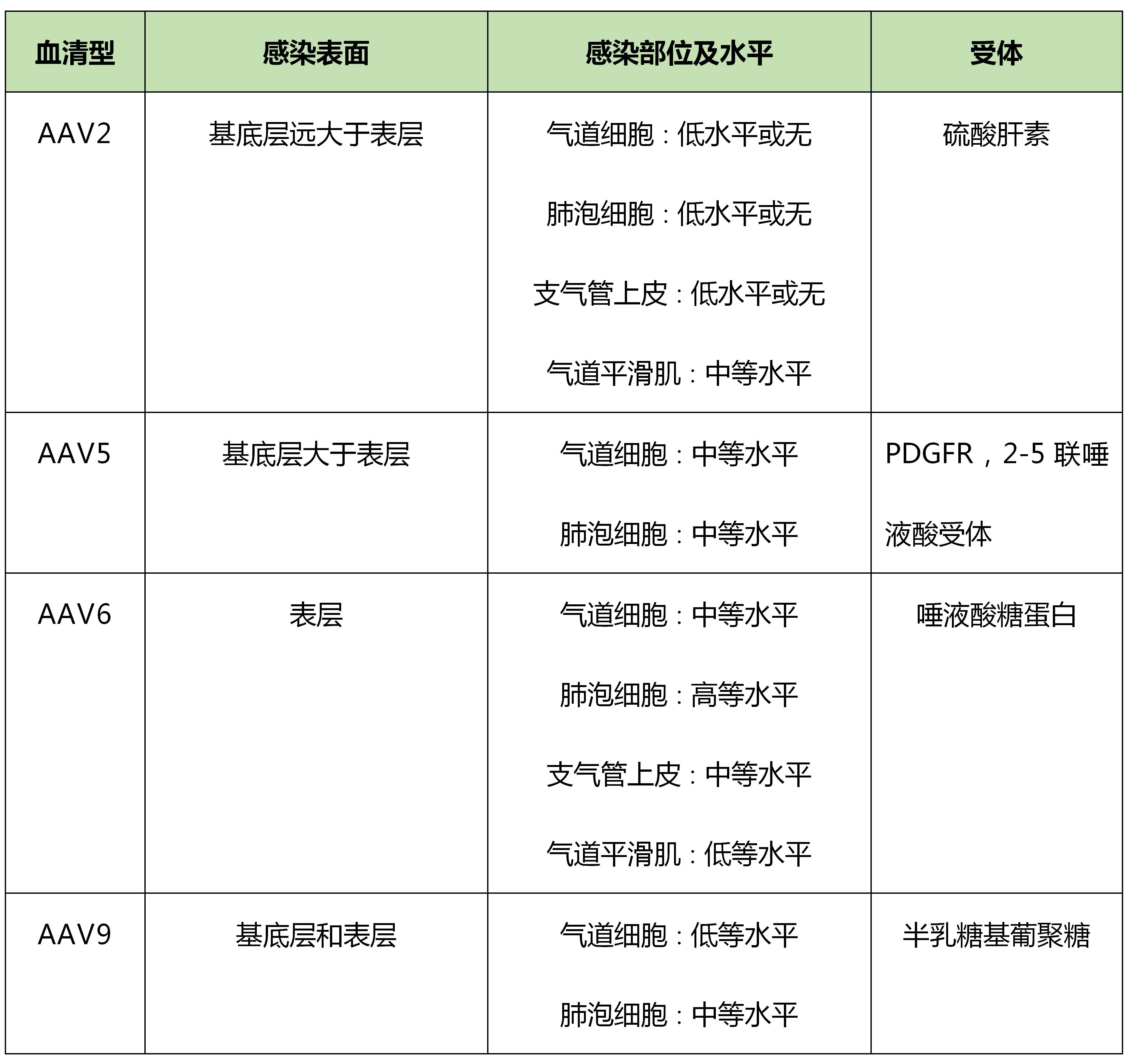
研究表明,针对肺部感染rAAV在血清型上的选择根据动物模型的不同而存在差异,主要体现在小鼠及较低等灵长类动物与高等灵长类动物之间。在小鼠及一些较低等的灵长类动物中,AAV5及AAV6是感染肺部的理想选择;针对高等灵长类动物,AAV1对肺部的感染效率更高;在肺癌的研究中,我们通常推荐AAV2血清型。
小鼠与低等灵长类动物肺部 AAV5/AAV6 AAV1 AAV2
种类
AAV血清型推荐
高等灵长类动物肺部
肺癌
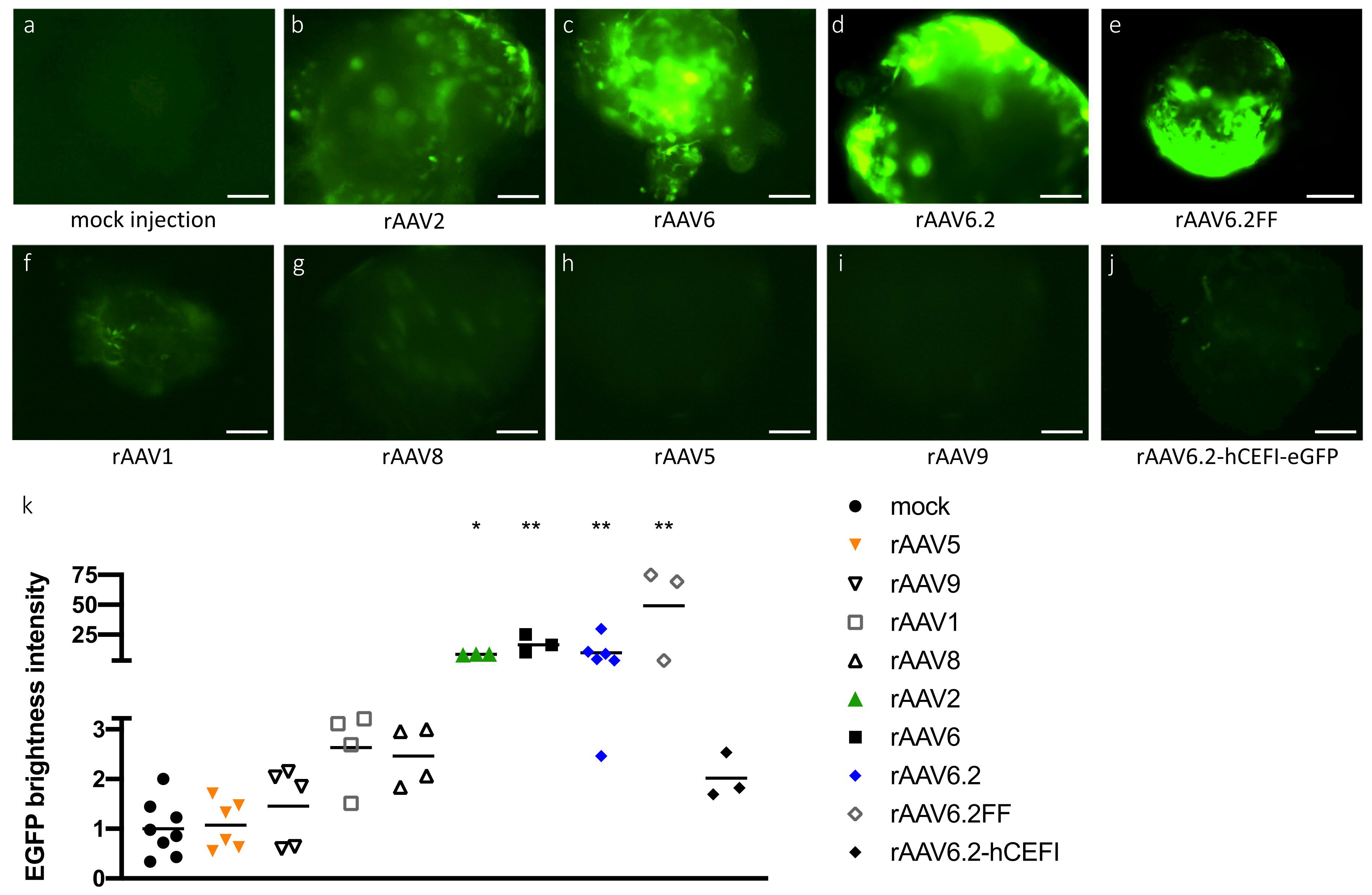
二、启动子的选择
根据不同的注射方式和实验目的,可选择不同的启动子以提高AAV在肺部的表达效率。如下图所示,CMV在启动真核基因表达方面具有极高的效率,可高效感染小鼠肺部;CAG同样具有出色的感染气道的能力。此外,如果要感染肺脏中特定类型的细胞,还可以考虑选择细胞特异性的启动子,如内皮细胞启动子ICAM2或者平滑肌细胞启动子SM22α,可实现对内皮细胞或平滑肌细胞的特异性感染。
三、常用的肺部注射方式
AAV感染肺部的方法有多种,较为常用的方法有鼻内滴注法、气管插管术、气管内注射,如果对肺部感染AAV的特异性要求较低,也可采用静脉注射、腹腔注射等方法,当进行肺癌成瘤实验时,也可采用瘤内注射的方式。下面对AAV感染肺部常用的三种方法进行介绍。
1、鼻内滴注法
鼻内滴注法是一种直接的AAV感染法,操作简单且对设备要求低,对新手实验员也同样适用。缺点是AAV颗粒容易沉积在上呼吸道(鼻道、鼻窦和咽)和胃肠道,如果需要有效地感染到下呼吸道,则可能需要更大剂量的AAV才能实现。
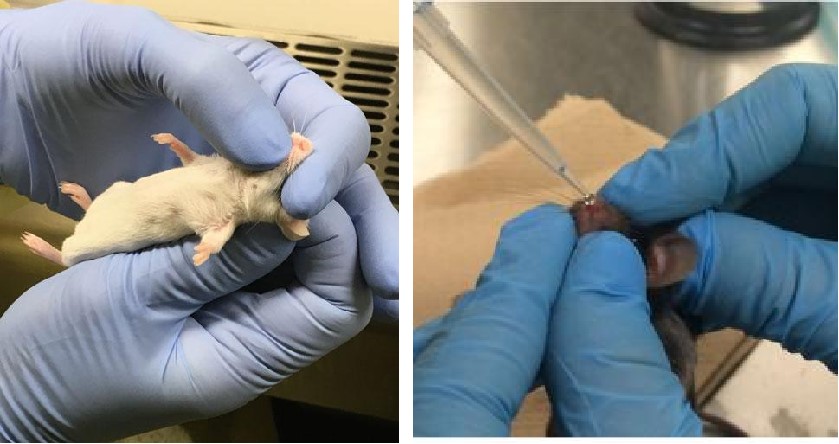
操作步骤
①腹腔注射***和甲苯噻嗪将小鼠麻醉;
注意:为了保持小鼠稳定的呼吸频率,不应过度麻醉。
②甲按上图所示两种方法将小鼠控制好,防止其用嘴呼吸;
③乙缓慢滴一滴AAV悬液于小鼠鼻孔内壁,待液体被吸入后再滴下一滴,重复此操作至40μL AAV悬液全部滴完;
④使小鼠保持上述姿势约30~60s,以便AAV悬液充分进入下呼吸道;
⑤待小鼠在笼中恢复10min后,重复上述操作,再次给药40μL(每只小鼠共给药80μL);
⑥将小鼠放回笼中直至完全清醒。
2、气管插管术
口腔气管插管术能够将病毒载体直接灌输入肺中,却没有外科手术的风险,并且避免了上呼吸道的病毒颗粒的损失。由于几乎所有AAV病毒颗粒都会到达肺内,所以要严格控制AAV的使用量。同时,与鼻内滴注法相比,口腔气管插管术需要一些特殊设备,操作起来也稍有难度。
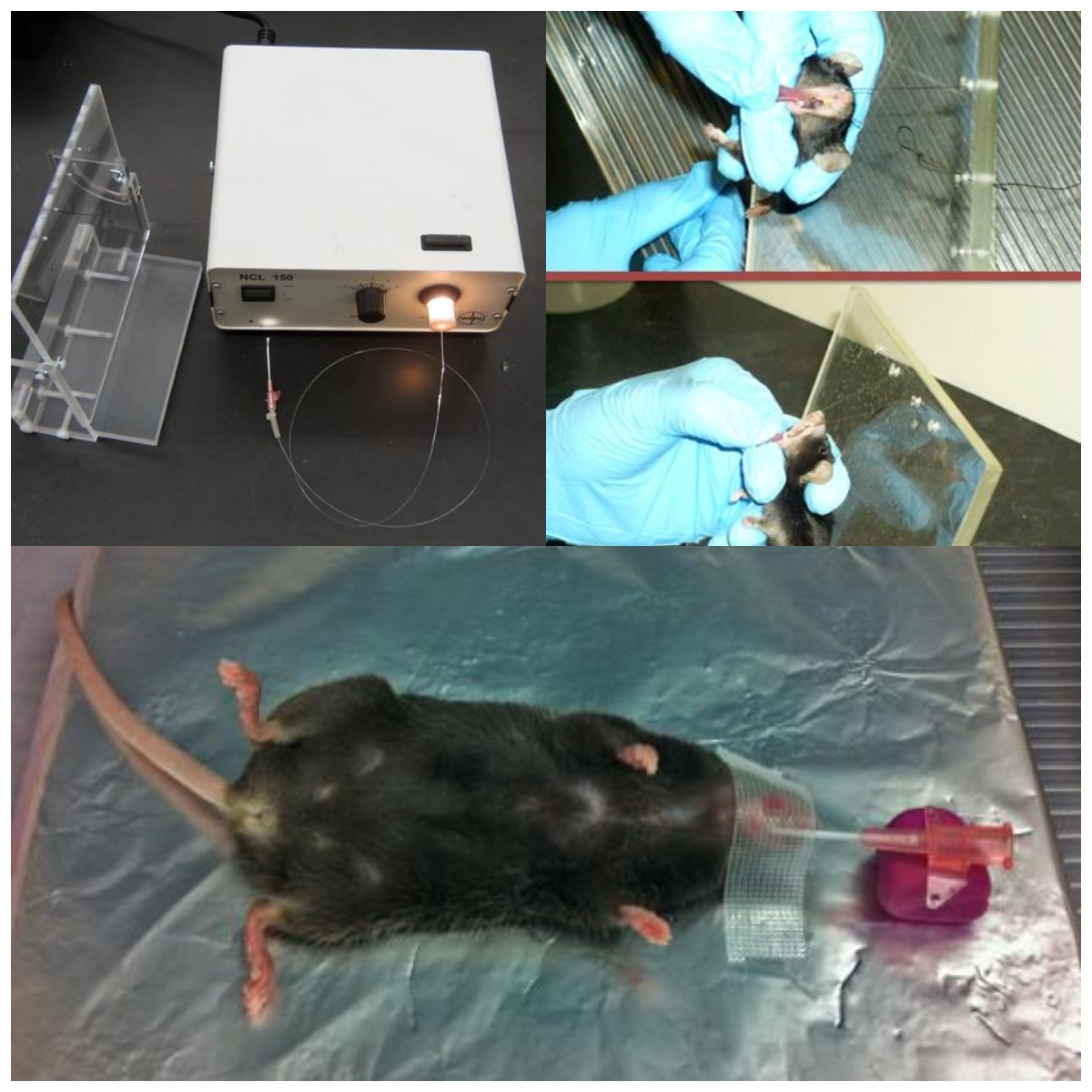
操作步骤
①腹腔注射***和甲苯噻嗪将小鼠麻醉;
注意:动物必须处于足够深的麻醉状态以防止运动或对载体的反应而打喷嚏或**;
②将小鼠放在垂直支架上,将门牙环置于小鼠上门牙上,让老鼠的腹部面向自己;
③轻轻地把小鼠舌头拉出来,并用拇指和食指按住,中指放在小鼠颈部和塑料支架之间;
④用食指、拇指在小鼠舌上牵引令其嘴张开,使插管路径伸直,并用中指在颈后调整头部角度;
⑤利用光纤作为光源和引导者,推动它通过可视声带(如果看不到声带,用中指作支撑,轻轻用力拉舌);
⑥光纤插入后,同时将导管向前推进约5mm,然后勿移动导管,取出光纤;
⑦使小鼠平躺,用胶带将导管固定在小鼠嘴部防止其移动,另一端用橡皮泥支撑;
⑧用注射器通过导管输入80μL AAV;
注意:在抽取80μL载体之前,吸取约100μL的空气至移液管尖,以防止载体的丢失,并促进载体深入肺部。
⑨等待5min,使AAV充分进入下呼吸道;
⑩把导管移出,将小鼠轻轻从工作台拿下,并将头部和胸部用折叠的纸巾小幅度垫高,以保证小鼠顺畅的呼吸;
⑪将小鼠放回笼中直至完全清醒。
3、气管内注射
与鼻内滴注相比,气管内注射能够提高AAV进入肺部的效率;与口腔气管插管法相比,设备更简单,操作更容易。然而,气管内注射具有极高的外科手术风险,包括出血、切口开裂、感染以及较长的恢复期等。不仅如此,由于小鼠气管窄小,很容易出现操作失误,将AAV注射到气管周围组织或食管中去。
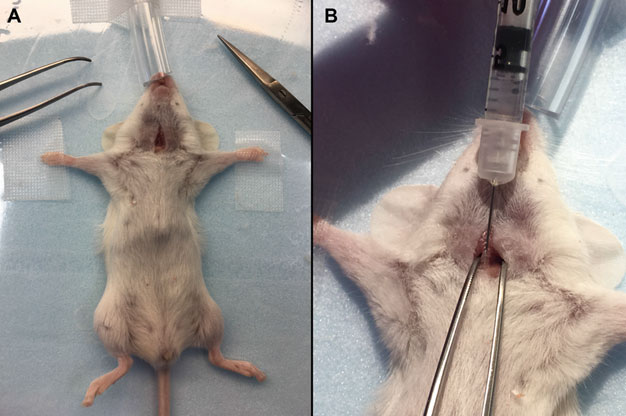
操作步骤
①腹腔注射***和甲苯噻嗪将小鼠麻醉;
②将小鼠以背卧姿势固定在啮齿动物工作台上,并将其前爪伸直固定;
③剃除颈部部分区域的鼠毛,并用碘伏做消毒处理;
④用手术剪刀在颈部做一个5~7mm的小切口;
⑤手握镊子固定住小鼠气管,另一只手握住注射器,使注射器针头斜面朝上,与气管成45°。
注意:一旦针头插入,轻轻地将针头向外移动,远离小鼠身体,确定针头是否正确地插入气管。
⑥将40~80μL 的AAV缓慢注入气管,等待5s后慢慢取出针管;
⑦缝合伤口,将小鼠放回笼中恢复,直到完全清醒。
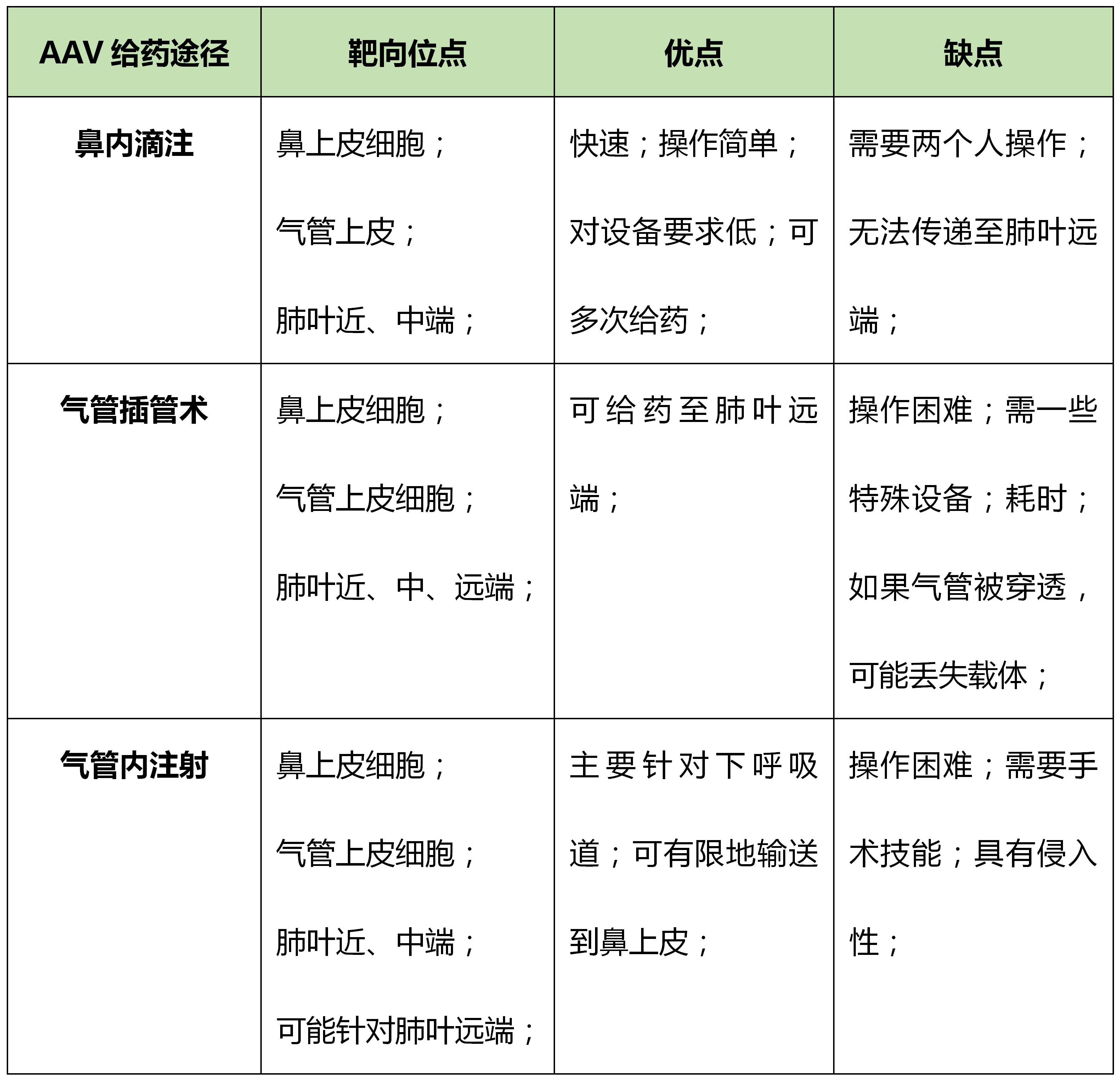
总结:AAV载体给药方式应根据研究人员的目标位点和技能进行选择。
本篇暂为大家分享如上内容,希望对大家的实验开展有所帮助,下期,小V将从客户的实际应用效果出发,为您献上AAV在肺部应用中的靶向策略之应用篇,我们共同学习!
关注“维真生物”公众号了解更多详情!

